一、化学sigma键是单键还是双键?怎么区分∏键和sigma键啊!看不懂
sigma键 是单键,是电子云“头碰头”
∏键 是P轨道的电子云肩并肩.实际上还是一个单键.
比如炭炭双键,是由一个sigma键和一个∏键组成的,
三键就是一个sigma键和2个∏键组成的,
二、什么事sigma键,什么是π键??
你好:
在讲π键和σ键之前我必须和你讲讲共价键的概念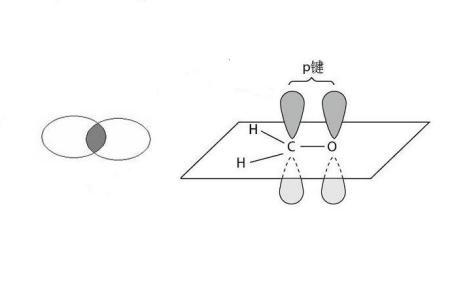
何为共价键呢?它的本质是原子之间共用电子对(或电子云重叠),因为每一个
原子周围都存在这电子,只是电子数的多少不同罢了,它们之间若要形成化合物,就可以通过共用电子对来实现,所以说共价键又可以说是两个相邻原子之间的强烈的相互作用。
然后根据它们的成键方式可以分为σ键和π键,它们之间的区分就要看电子云是如何重叠的(电子云就是每个原子存在电子的一个区域),σ键是电子云“头碰头”,它们成轴对称;而π键是电子云“肩并肩”,它们则关于一个平面对称。
具体的请看图吧
左边是σ键, 右边是π键。
但楼主请要注意,不是所有的原子都可以通过共用电子对来形成化合物,有些是通过离子键,有些是通过金属键等,就要具体问题具体分析了。
总之等你上了高中,你若对化学感兴趣的话,高二选化学就可以了,然后高二你就会学到这些东西了,你们老师也一定会归纳出比这更详细的。
三、西格玛键和π键各表示什么
sp:一个s轨道和一个p轨道进行杂化,混合后重新分成2个完全等价的轨道,直线型。剩下的两个p轨道与该直线垂直,可用于成派键。
sp2:一个s轨道和两个p轨道进行杂化,形成3个完全等价的轨道,处于平面正三角形。剩下的一个p轨道与该平面垂直,可用于成派键。
sp3:一个s轨道和三个p轨道进行杂化,形成四个完全等价的轨道,在空间成正四面体结构。
成键轨道和反键轨道是分子轨道中的概念,要与原子轨道区分开。相似的可认为是“杂化”,但两者概念绝对不同!!!
就是说:1首先能量要守恒,有能量升高的轨道,就要有能量降低的轨道,前者为反键轨道,后者为成键轨道。2因为成键轨道能量比原来的原子轨道能量低,所以对于成键有“正”作用,反键轨道能量高,对成键有“负”作用,当相应的成键轨道与反键轨道上都填满电子时,两轨道对成键作用为零。3还有能量与原子轨道一致的非键轨道,既不是成键轨道也不是非键轨道,对成键作用可认为是零。
四、化学sigma键是单键还是双键 怎么区分sigma键和∏键啊 看不懂啊
碳碳单键都是由σ(sigma)键构成的
而碳碳双键则是由一个σ和一个π键构成的,所谓σ键是由两个相同或不相同的原子轨道沿轨道对称轴方向相互重叠而形成的共价键(称为头碰头),叫做σ键。若原子轨道的重叠部分,对键轴所在的某一特定平面具有反对称性,所成的键就称为π键(肩并肩)。
五、谁能非常详细的解释一下什么是π键,什么是sigma键,一定要清楚,给高分~
π键是由于平行轨道重叠形成的
两个轨道纵向的相遇,它是比σ更弱的键
π键中的电子有时也被叫做π电子
判断的话很容易
如果是只有单键
那么它就是σ键
拥有双键和三键的其中只有一个σ键
余下的则是π键(包括大π键)
六、π键和σ键的区别是什么?
主要还是它们的形成方式不一样。σ键是外轨道头碰头交盖形成,π键是外轨道肩并肩交盖形成的。而且两种轨道的结合紧密性有差别,σ键较紧,但π键则容易形成共轭结构
相关介绍:
共价键,也称为分子键,是涉及原子之间电子对的共享的化学键。被共享的电子称为共享对或键合对。
原子之间在共享电子时产生的吸引力和排斥力的稳定平衡被称为电子对键。对于许多分子来说,电子的共享使得每个原子获得满填充的壳层,即稳定的电子构型。在有机化学中,共价键比离子键更常见。
共价键包括许多种类型,包括σ键,π键,金属-金属键,抓氢键、弯曲键和三中心双电子键术语共价键可追溯到1939年。共价键英文covalent bond中前缀 co- 表示“联合、在行动中联合、合作程度较低”等,因此,“同价键”本质上意味着原子共享化合价,就像价键理论中所讨论的那样。
在氢分子H2中氢原子通过电子对键共享两个电子。电负性相似原子之间的键共价性最强。因此,共价键不一定要求这两个原子是相同的元素,只需要他们电负性相近。两个以上原子之间共享电子的共价键效应被称为离域的。